Аміак (від грец. Hals ammoniakos, буквально - Амонового сіль , Так називався нашатир, який отримували біля храму бога Амона в Єгипті) NH3, безбарвний газ з різким запахом. молекула має форму правильної піраміди (див. рис. 1). Зв'язки N-Н полярні; 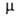 4,85 * 10-30 Кл * м (0-150 ° С); енергія зв'язку N-Н 389,4 кДж / моль. поляризуемость молекули 22,6 * 10-25 см3. У атома N є неподіленої пари електронів, яка обумовлює здатність аміаку до утворення донорно-акцепторної і водневої зв'язків. Існування водневих зв'язків і значна полярність молекул аміаку - причини сильної взаємодії між ними, внаслідок чого фізичні властивості аміаку в чому аномальні в порівнянні з властивостями однотипних з'єднань (РН3, SbH3, AsH3). Для NH3 Т. пл. -77,7 ° C, Т. кип. -33,35 ° C; dt4 0,790 (-40 ° C), 0,681 (-33,35 ° C), 0,639 (0 ° C), 0580 (40 ° C); t крит 133 ° С, pкріт 11,425 кПа, dкріт 0,235 г / см3;
4,85 * 10-30 Кл * м (0-150 ° С); енергія зв'язку N-Н 389,4 кДж / моль. поляризуемость молекули 22,6 * 10-25 см3. У атома N є неподіленої пари електронів, яка обумовлює здатність аміаку до утворення донорно-акцепторної і водневої зв'язків. Існування водневих зв'язків і значна полярність молекул аміаку - причини сильної взаємодії між ними, внаслідок чого фізичні властивості аміаку в чому аномальні в порівнянні з властивостями однотипних з'єднань (РН3, SbH3, AsH3). Для NH3 Т. пл. -77,7 ° C, Т. кип. -33,35 ° C; dt4 0,790 (-40 ° C), 0,681 (-33,35 ° C), 0,639 (0 ° C), 0580 (40 ° C); t крит 133 ° С, pкріт 11,425 кПа, dкріт 0,235 г / см3; 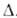 Н ° ісп 23,27 кДж / моль,
Н ° ісп 23,27 кДж / моль,  Н ° пл, 5,86 кДж / моль; для газу Ср ° 35,63 Дж / (моль * К),
Н ° пл, 5,86 кДж / моль; для газу Ср ° 35,63 Дж / (моль * К), 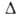 Ноo6p -45,94 кДж / моль, S ° 298 192,66 ДжДмоль * К).
Ноo6p -45,94 кДж / моль, S ° 298 192,66 ДжДмоль * К).
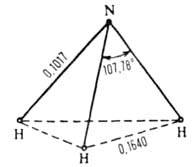
Мал. 1. Структура молекули NH3 (довжина зв'язку - в нм).
Твердий аміак - безбарвні кристали з кубічної гратами (а = = 0,515 нм, 2 = 4, просторова група Р213). У рідкому аміаку молекули асоційовані аж до критичної температури, електролітична дисоціація зовсім незначна, твір концентрацій [NH;] [NH2] становить 10-22 (-33,4 ° С);  8 * 106 Ом * см;
8 * 106 Ом * см;  25,4 (- 77 ° С). Рідкий аміак розчиняє лужні і лужноземельні метали, Al, Eu, Yb, P, S, I, багато інтерметалліді та ін. Розчини металів в рідкому аміак мають металеву провідність, оскільки містять іони металу і сольватовані електрони; вони є найсильнішими восстановителями . Розчинені в аміаку з'єднання з полярним ковалентним або іонним зв'язком диссоциируют на іони. У рідкому аміак багато речовини здатні отщеплять протон , Кислотні властивості проявляють в ньому навіть вуглеводи , Аміди кислот, деякі вуглеводні .
25,4 (- 77 ° С). Рідкий аміак розчиняє лужні і лужноземельні метали, Al, Eu, Yb, P, S, I, багато інтерметалліді та ін. Розчини металів в рідкому аміак мають металеву провідність, оскільки містять іони металу і сольватовані електрони; вони є найсильнішими восстановителями . Розчинені в аміаку з'єднання з полярним ковалентним або іонним зв'язком диссоциируют на іони. У рідкому аміак багато речовини здатні отщеплять протон , Кислотні властивості проявляють в ньому навіть вуглеводи , Аміди кислот, деякі вуглеводні .
Розчинність аміаку в воді (% По масі): 42,8 (0 ° С, 33,1 (20 ° С), 23,4 (40 ° С), 14,1 (60 ° С). Щільність водних розчинів (г / см3): 0,970 (8% по масі NH3), 0,947 (16%), 0,889 (32%), 0,832 (50%), 0,733 (75%). Для нескінченно розбавленого водного розчину  Але розчинення 133,26 кДж / моль. Аміак добре розчинний (але гірше, ніж у воді) в спирті , ацетоні , Хлороформі, бензолі та інших органічних розчинниках. утворює гідрати з двома (т. пл. ок. - 90 ° С), однієї (- 79 ° С) і 0,5 (- 78,2 ° С) молекулами води.
Але розчинення 133,26 кДж / моль. Аміак добре розчинний (але гірше, ніж у воді) в спирті , ацетоні , Хлороформі, бензолі та інших органічних розчинниках. утворює гідрати з двома (т. пл. ок. - 90 ° С), однієї (- 79 ° С) і 0,5 (- 78,2 ° С) молекулами води.
В системі NH3-Н2О встановлено існування евтектики: лід + NН3 * Н2О (33,23% по масі NH3, т. Пл. -100,3оС), NH3 * H2O + NH3 * 0,5H2O (55,11%, -83 , 3 ° С), NH3 * H2O + NH3 (80,05%, - 92,5 ° С). У водному розчині аміак частково іонізований на NH4 + і ОН, що обумовлює лужну реакцію розчину (рКа 9,247).
Розкладання аміак на водень і азот стає помітним вище 1200-1300 ° С, в присутності каталізаторів - вище 400 ° С. аміак досить реакционноспособен. Для нього типові реакції приєднання, зокрема протон . при взаємодії з кислотами. В результаті утворюються солі амонію, які за багатьма властивостями подібні солям лужних металів.
Аміак - основа Льюїса, приєднує не тільки Н +, а й інші акцептори електронів , Наприклад BF3 з утворенням BF3 * NH3. дає амміни при взаємодії з солями. Лужні і лужноземельні метали реагують з рідким і газоподібним аміаком, даючи аміди. При нагріванні в атмосфері аміаку багато метали і неметали (Zn, Cd, Fe, Cr, B, Si та ін.) утворюють нітриди . Рідкий аміак взаємодіє з сірої по реакції: 10S + 4NH3 -> 6H2S + N4S4. Близько 1000 ° С аміак реагує з вугіллям, утворюючи HCN і частково розкладаючись на N2 і Н2.
Велике практичне значення має реакція аміаку з СО2, яка призводить до утворення карбамат амонію NH2COONH4, який при 160-200 ° С і тиску до 40 МПа розпадається на воду і сечовину . Водень в аміаку може бути заміщений галогенами. Аміак горить в атмосфері О2, утворюючи воду і N2. Каталітичним окисленням аміаку отримують NO - проміжний продукт у виробництві HNO3. Каталітичне окислення аміаку в суміші з СН4 дає HCN. Такі сильні окислювачі, як Y2J2, K2Cr2J7і КМnО4, окислюють аміак у водних розчинах. Газоподібний аміак окислюється Вr2 і Сl2 до N2.

Мал. 2. Залежність рівноважного вмісту NH3 в газовій суміші (Н2: N2 = 3) від тиску при різних температурах.

Мал. 3. Агрегат синтезу аміаку потужністю 1360 т / добу: 1-компресори; 2-підігрівачі; 3-а. пара . для тарування сераорг. соед .; 4-адсорбер H2S; 5-трубчаста піч (первинний риформінг); 6-шахтний конвертор (вторинний риформинг); 7-парові котли; 8-конвертори СО; 9-абсорбер СО2; 10-кип'ятильник; 11 -регенератор розчину моноетаноламіна; 12-насос; 13-а. пара . для гідрування залишкових СО і СО2; 14-повітряні холодильники; 15-конденсації. колона; 16-випарник рідкого NH3 (для охолодження газу і виділення NH3); 17-колона синтезу NН3; 18-водопідігрівач; 19-теплообмінник; 20-сепаратор.
Основний промисловий спосіб отримання аміаку - по реакції 1 / 2N2 + 3 / 2H2  NH3. Зрушенню рівноваги вправо сприяють підвищення тиску і зниження температури (див. Рис. 2). Тепловий ефект реакції при 29,4 МПа складає 52,38 кДж / моль при 500 ° С і 51,29 кДж / моль при 400 ° С (з урахуванням теплоти змішування газів). Процес проводять в присутності каталізатора - Fe, активованого К2О, А12О3, СаО і ін. Каталітичні отрути - сірчисті і кисень з'єднання. для відомих каталізаторів швидкість реакції описується рівнянням Тьомкіна - Пижева:
NH3. Зрушенню рівноваги вправо сприяють підвищення тиску і зниження температури (див. Рис. 2). Тепловий ефект реакції при 29,4 МПа складає 52,38 кДж / моль при 500 ° С і 51,29 кДж / моль при 400 ° С (з урахуванням теплоти змішування газів). Процес проводять в присутності каталізатора - Fe, активованого К2О, А12О3, СаО і ін. Каталітичні отрути - сірчисті і кисень з'єднання. для відомих каталізаторів швидкість реакції описується рівнянням Тьомкіна - Пижева:
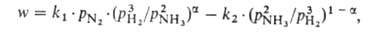
де w -спостерігається швидкість процесу, що дорівнює різниці швидкостей утворення і розкладання A., kl і k2- константи швидкості утворення і розкладання аміак, рH2, pN2 і pNH3 -Парціальний тиск відповідного газу, 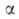 = 0,5 для більшості промислових каталізаторів. При тиску ~ 30 МПа і температурі ~ 500 ° С, використовуваних на практиці, рівноважна концентрація аміак в газовій суміші складає ~ 30%. Однак рівновага на виході з колони синтезу, як правило, не досягається, оскільки з метою збільшення продуктивності одиниці об'єму каталізатора процес проводять при високих об'ємних швидкостях (~ 15000 ч -1). Тому при одноразовому проходженні через масу каталізатора можливе перетворення в аміак лише 15-25% вихідної газової суміші. Для повного перетворення необхідна багаторазова циркуляція, яку здійснюють за допомогою компресора. У цикл безперервно вводять свіжу газову суміш замість пішла на утворення аміаку. Основна сировина (~ 90%) для отримання Н2 у виробництві аміаку - природний газ, що переробляється в основному методом двуступенчатой парової конверсії; незначну частку (менше 10%) становить коксовий газ і електролітичний водень. Потужність установок з виробництва аміаку з природного газу 200 і 420 тис. Т / рік. Виробництво аміак в агрегатах потужністю 1360 т / добу здійснюється в одній технологічній лінії (див. Рис. 3) і включає наступні стадії: 1) очищення природного газу від сірчистих сполук каталітичним гідруванням їх до H2S з подальшим його поглинанням ZnO; 2) парову конверсію природного газу під тиском 3,8 МПа при 860 ° С на каталізаторі Ni-Al в трубчастої печі (первинний риформінг); 3) паровоздушную конверсію залишкового метану в шахтному конверторі (вторинний риформинг) при 990-1000 ° С і 3,3 МПа, на каталізаторі Ni-Al; на цьому етапі водень збагачується азотом повітря для отримання суміші складу Н2: N2 = 3, що надходить на синтез NH3; 4) конверсію СО до СО2 і Н2 спочатку при 450 ° С і 3,1 МПа на каталізаторі Fe-Cr, потім при 200-260 ° С і 3,0 МПа на каталізаторі Zn-Cr-Cu; 5) очистку Н2 від СО2 абсорбцією розчином моноетаноламіна або гарячим розчином К2СО3 при 2,8 МПа; 6) очистку газу шляхом гідрування від залишкових СО і СО2 в присутності Ni-Al при 280 ° С і 2,6 МПа; 7) компримування очищеного газу до 30 МПа і синтез аміаку на залізному промотувати каталізаторі при 420-500 ° С. Реактор синтезу аміаку представлений на рис. 4.
= 0,5 для більшості промислових каталізаторів. При тиску ~ 30 МПа і температурі ~ 500 ° С, використовуваних на практиці, рівноважна концентрація аміак в газовій суміші складає ~ 30%. Однак рівновага на виході з колони синтезу, як правило, не досягається, оскільки з метою збільшення продуктивності одиниці об'єму каталізатора процес проводять при високих об'ємних швидкостях (~ 15000 ч -1). Тому при одноразовому проходженні через масу каталізатора можливе перетворення в аміак лише 15-25% вихідної газової суміші. Для повного перетворення необхідна багаторазова циркуляція, яку здійснюють за допомогою компресора. У цикл безперервно вводять свіжу газову суміш замість пішла на утворення аміаку. Основна сировина (~ 90%) для отримання Н2 у виробництві аміаку - природний газ, що переробляється в основному методом двуступенчатой парової конверсії; незначну частку (менше 10%) становить коксовий газ і електролітичний водень. Потужність установок з виробництва аміаку з природного газу 200 і 420 тис. Т / рік. Виробництво аміак в агрегатах потужністю 1360 т / добу здійснюється в одній технологічній лінії (див. Рис. 3) і включає наступні стадії: 1) очищення природного газу від сірчистих сполук каталітичним гідруванням їх до H2S з подальшим його поглинанням ZnO; 2) парову конверсію природного газу під тиском 3,8 МПа при 860 ° С на каталізаторі Ni-Al в трубчастої печі (первинний риформінг); 3) паровоздушную конверсію залишкового метану в шахтному конверторі (вторинний риформинг) при 990-1000 ° С і 3,3 МПа, на каталізаторі Ni-Al; на цьому етапі водень збагачується азотом повітря для отримання суміші складу Н2: N2 = 3, що надходить на синтез NH3; 4) конверсію СО до СО2 і Н2 спочатку при 450 ° С і 3,1 МПа на каталізаторі Fe-Cr, потім при 200-260 ° С і 3,0 МПа на каталізаторі Zn-Cr-Cu; 5) очистку Н2 від СО2 абсорбцією розчином моноетаноламіна або гарячим розчином К2СО3 при 2,8 МПа; 6) очистку газу шляхом гідрування від залишкових СО і СО2 в присутності Ni-Al при 280 ° С і 2,6 МПа; 7) компримування очищеного газу до 30 МПа і синтез аміаку на залізному промотувати каталізаторі при 420-500 ° С. Реактор синтезу аміаку представлений на рис. 4.
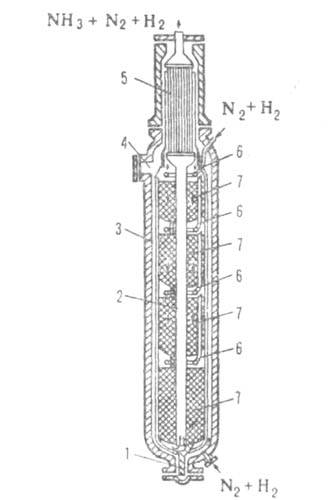
Мал. 4. Колона синтезу аміаку: 1-люк для вивантаження каталізатора; 2-центр, труба; 3-корпус; 4-люк для завантаження каталізатора; 5 -Теплообмінник; 6-труби для введення холодного газу; 7 - каталізатор.
Аміак випускається в рідкому вигляді або у вигляді водного розчину - аміачної води, найчастіше з вмістом 25% NH3. аміак, що поставляється на потреби промисловості, містить не менше 99,96% по масі NH3, до 0,04% Н2О, до 2 мг / л машинного масла, до 1,0 мг / л Fe. В технічний аміак, що транспортується по трубопроводу, додається до 0,2-0,4% Н2О для інгібірування корозії сталі. Аміак виявляється по характерному запаху. Папірець, змочений розчином Hg2 (NO3) 2, при дії аміак чорніє. Малі кількості аміаку у водних розчинах відкривають за допомогою реактиву Несслера. Кількісно аміак визначають тітріметріческі.
Застосовують аміак у виробництві HNO3, сечовини, NH4NO3, (NH4) 2CO3, (NH4) 2SO4 і ін., Амофосу, уротропіну, як рідке добриво, як холодоагент, Світове виробництво аміак склало в 1982 близько 89 млн. Т, в тому числі в СРСР 17,76, США 14.06, СРР 3,14, Франції 1,9, Японії 2,01, ФРН 1,92 млн. т.
Рідкий аміак зберігають при 2,0 МПа або при атм. тиску і - 33 ° С. Перевозять в сталевих балонах (забарвлені в жовтий колір, мають напис "Аміак" чорного кольору), залізничних і автомобільних цистернах, по воді - в спеціальних танкерах, транспортують також по трубопроводах. При вмісті в повітрі 0,5% за обсягом аміак сильно дратує слизисті оболонки. При гострому отруєнні уражаються очі і дихальні шляхи, при хронічних отруєннях спостерігаються розлад травлення, катар верхніх дихальних шляхів, ослаблення слуху. Рідкий аміак викликає сильні опіки шкіри. ГДК 20 мг / м3. Суміш аміак з повітрям вибухонебезпечна, КПВ 15-28%; для повітряно-аміачних сумішей, що містять 9-57% за об'ємом аміак, т. доп. ок. 1000 ° С. Чистий аміак був отриманий Дж. Прістлі в 1774.
Літ .: Малина І. К., Розвиток досліджень в області синтезу аміаку, М., 1973; Алексєєв А. М. [и др.], "Ж. Всес. Хім. О-ва ім. Д. І. Менделєєва", 1978, т. 23, [№] 1, з 31-38; Синтез аміаку, М., 1982; Жаворонков Н. М., Овчаренко Б. Г., Охотський С. М., в кн .: Розвиток хімічної промисловості в СРСР, т. 2, М., 1984, с. 7-37. Див. Також літ. при ст. Азот. Н.М. Жаворонков, Л. Д. Кузнецов.
Додаткова інформація: " Аміак: хімічні та фізичні властивості ".