Стор про нцій (лат. Strontium), Sr, хімічний елемент II групи періодичної системи Менделєєва, атомний номер 38, атомна маса 87,62, сріблясто-білий метал. Природний С. складається з суміші чотирьох стабільних ізотопів: 84Sr, 86Sr, 87Sr і 88Sr; найбільш поширений 88Sr (82,56%).
Штучно отримані радіоактивні ізотопи з масовими числами від 80 до 97, в тому числі 90Sr (Т 1/2 = 27,7 року), що утворюється при розподілі урану. У 1790 шотландський лікар А. Крофорд, досліджуючи знайдений поблизу населеного пункту Строншіан (в Шотландії) мінерал, виявив, що він містить невідому раніше «землю», яка була названа стронціаніт. Пізніше виявилося, що це окис С. SrO. У 1808 Г. Деві , Піддаючи електролізу з ртутним катодом суміш зволоженою гідроксиду Sr (ВІН) 2 з окисом ртуті, отримав амальгаму С.
Поширення в природі. Середній вміст С. в земній корі (кларк) 3,4-102% по масі, в геохімічних процесах він є супутником кальцію. Відомо близько 30 мінералів С .: найважливіші - целестин SrSO4 і стронціаніт SrCO3. У магматичних породах С. знаходиться переважно в розсіяному вигляді і входить у вигляді ізоморфної домішки в кристалічну решітку кальцієвих, калієвих і барієвих мінералів. В біосфері С. накопичується в карбонатних породах і особливо в опадах солоних озер і лагун (родовища целестина).
Фізичні та хімічні властивості. При кімнатній температурі решітка С. кубічна гранецентрированная (a-Sr) з періодом а = 6,0848 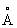 ; при температурі вище 248 ° С перетворюється в гексагональну модифікацію (b-Sr) з періодами решітки а = 4,32
; при температурі вище 248 ° С перетворюється в гексагональну модифікацію (b-Sr) з періодами решітки а = 4,32 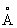 і з = 7,06
і з = 7,06  ; при 614 ° С переходить в кубічну об'емноцентрірованную модифікацію (g-Sr) з періодом а = 4,85
; при 614 ° С переходить в кубічну об'емноцентрірованную модифікацію (g-Sr) з періодом а = 4,85 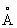 . Атомний радіус 2,15
. Атомний радіус 2,15 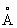 , Іонний радіус Sr2 + 1,20
, Іонний радіус Sr2 + 1,20  . Щільність a - форми 2,63г / см3 (20 ° С); tпл 770 ° С, tkіп 1 383 ° С; Питома теплоємність 737,4 кДж / (кг · К) [0,176 кал / (г · ° С)]; питомий електроопір 22.76-10-6 ом · см 3 С. парамагнитен, атомна магнітна сприйнятливість при кімнатній температурі 91,2 · 10-6. С. - м'який пластичний метал, легко ріжеться ножем. Конфігурація зовнішньої електронної оболонки атома Sr 5s2, в з'єднаннях зазвичай має ступінь окислення +2. С. - лужноземельний метал, за хімічними властивостями схожий з Ca і Ba. Металевий С. швидко окислюється на повітрі, утворюючи жовтувату поверхневу плівку, яка містить окис SrO, перекис SrO2 і нітрид Sr3N2. З киснем при звичайних умовах утворює окис SrO (сірувато-білий порошок), яка на повітрі легко переходить в карбонат SrCO3: з водою енергійно взаємодіє, утворюючи гідроокис Sr (OH) 2 - підстава сильніше, ніж Ca (OH) 2. При нагріванні на повітрі легко запалюється, а порошкоподібний С. на повітрі самозаймається, тому зберігають С. в герметично закритих судинах під шаром гасу. Бурхливо розкладає воду з виділенням водню і утворенням гідроксиду. При підвищених температурах взаємодіє з воднем (> 200 ° С), азотом (> 400 ° С), фосфором, сіркою і галогенами. При нагріванні утворює интерметаллические з'єднання з металами, наприклад SrPb3, SrAg4, SrHg8, SrHg12. З солей С. добре розчиняються у воді нітрати (крім фториду), нітрат, ацетат, хлорат; важко розчиняються карбонат, сульфат, оксалат і фосфат. Осадження С. у вигляді оксалату і сульфату використовують для його аналітичного визначення. Багато солі С. утворюють кристалогідрати, що містять від 1 до 6 молекул кристалізаційної води. Сульфід SrS поступово гідролізується водою: нітрид Sr3N2 (чорні кристали) легко розкладається водою з виділенням NH3 та Sr (OH) 2. С. добре розчиняється в рідкому аміаку, даючи розчини темно-синього кольору.
. Щільність a - форми 2,63г / см3 (20 ° С); tпл 770 ° С, tkіп 1 383 ° С; Питома теплоємність 737,4 кДж / (кг · К) [0,176 кал / (г · ° С)]; питомий електроопір 22.76-10-6 ом · см 3 С. парамагнитен, атомна магнітна сприйнятливість при кімнатній температурі 91,2 · 10-6. С. - м'який пластичний метал, легко ріжеться ножем. Конфігурація зовнішньої електронної оболонки атома Sr 5s2, в з'єднаннях зазвичай має ступінь окислення +2. С. - лужноземельний метал, за хімічними властивостями схожий з Ca і Ba. Металевий С. швидко окислюється на повітрі, утворюючи жовтувату поверхневу плівку, яка містить окис SrO, перекис SrO2 і нітрид Sr3N2. З киснем при звичайних умовах утворює окис SrO (сірувато-білий порошок), яка на повітрі легко переходить в карбонат SrCO3: з водою енергійно взаємодіє, утворюючи гідроокис Sr (OH) 2 - підстава сильніше, ніж Ca (OH) 2. При нагріванні на повітрі легко запалюється, а порошкоподібний С. на повітрі самозаймається, тому зберігають С. в герметично закритих судинах під шаром гасу. Бурхливо розкладає воду з виділенням водню і утворенням гідроксиду. При підвищених температурах взаємодіє з воднем (> 200 ° С), азотом (> 400 ° С), фосфором, сіркою і галогенами. При нагріванні утворює интерметаллические з'єднання з металами, наприклад SrPb3, SrAg4, SrHg8, SrHg12. З солей С. добре розчиняються у воді нітрати (крім фториду), нітрат, ацетат, хлорат; важко розчиняються карбонат, сульфат, оксалат і фосфат. Осадження С. у вигляді оксалату і сульфату використовують для його аналітичного визначення. Багато солі С. утворюють кристалогідрати, що містять від 1 до 6 молекул кристалізаційної води. Сульфід SrS поступово гідролізується водою: нітрид Sr3N2 (чорні кристали) легко розкладається водою з виділенням NH3 та Sr (OH) 2. С. добре розчиняється в рідкому аміаку, даючи розчини темно-синього кольору.
Отримання і застосування. Основною сировиною для отримання сполук С. служать концентрати від збагачення целестина і стронціанітом. Металевий С. отримують відновленням окису С. алюмінієм при 1100-1150 ° С:
4SrO + 2AI = 3Sr + SrO · Al2O3.
Процес ведуть в електровакуумних апаратах [при 1 н / м2 (10 -2 мм рт. Ст.)] Періодичної дії. Пари С. конденсуються на охолодженій поверхні вставленого в апарат конденсатора; після закінчення відновлення апарат заповнюють аргоном і розплавляють конденсат, який стікає в изложницу. С. отримують також електролізом розплаву, що містить 85% SrCl2 і 15% KCI, проте при цьому процесі вихід по току невеликий, а метал виявляється забрудненим солями, нітридом і окисом. У промисловості електролізом з рідким катодом отримують сплави С., наприклад з оловом.
Практичне застосування металевого С. невелика. Він служить для розкислення міді і бронзи. -90Sr - джерело b-випромінювання в атомних електричних батареях. С. використовується для виготовлення люмінофорів і фотоелементів, а також сильно пірофорних сплавів. Окис С. входить до складу деяких оптичних стекол і оксидних катодів електронних ламп. З'єднання С. забарвлюють полум'я в інтенсивний вишнево-червоний колір, завдяки чому деякі з них знаходять застосування в піротехніці. Стронціаніт вводять в шлак для очищення високосортних сталей від сірки і фосфору; карбонат С. використовують в неіспаряющіхся геттера , А також додають до складу стійких до атмосферних впливів глазурі і емалей для покриття порцеляни, сталей і жароміцних сплавів. Хромат SrCrO4 - дуже стійкий пігмент для виготовлення художніх фарб, титанат SrTiO3 застосовують як сегнетоелектрік, він входить до складу п'єзокераміки. Стронцієві солі жирних кислот ( «стронцієві мила») використовують для виготовлення спеціальних консистентних мастил.
Солі та сполуки С. малотоксични; при роботі з ними слід керуватися правилами техніки безпеки з солями лужних і лужноземельних металів. Див. Також розділи Стронцій в організмі і Стронцій-90.
М. Є. Ерликіна.
Стронцій в організмі. С. - складова частина мікроорганізмів, рослин і тварин. У морських радіолярій (акантарий) скелет складається з сульфату С. - целестина. Морські водорості містять 26-140 мг С. на 100 г сухої речовини, наземні рослини - 2,6, морські тварини - 2-50, наземні тварини - 1,4, бактерії - 0,27-30. Накопичення С. різними організмами залежить не тільки від їх виду, особливостей, але і від співвідношення в середовищі С. з ін. Елементами, головним чином з Ca і Р, а також від адаптації організмів до певної геохимической середовищі.
Тварини отримують С. з водою і їжею. Всмоктується С. тонким, а виділяється в основному товстим кишечником. Ряд речовин (полісахариди водоростей, катіонообмінні смоли) перешкоджає засвоєнню С. Головне депо С. в організмі - кісткова тканина, в золі якій міститься близько 0,02% С. (в ін. Тканинах - близько 0,0005%). Надлишок солей С. в раціоні щурів викликає «стронцієвий» рахіт. У тварин, що мешкають на грунтах із значною кількістю целестина, спостерігається підвищений вміст С. в організмі, що призводить до ламкості кісток, рахіту та ін. Захворювань. В біогеохімічних провінціях, багатих С. (ряд районів Центральної і Східної Азії, Північної Європи та ін.), Можлива т. Н. уровская хвороба .
Г. Г. Полікарпов.
Стронцій-90. Серед штучних ізотопів С. його довгоживучий радіонуклід 90Sr - один з важливих компонентів радіоактивного забруднення біосфери. Потрапляючи в навколишнє середовище, 90Sr характеризується здатністю включатися (головним чином разом з Ca) в процеси обміну речовин у рослин, тварин і людини. Тому при оцінці забруднення біосфери 90Sr прийнято розраховувати відношення 90Sr / Ca в стронцієвих одиницях (1 с. Е. = 1 мк мккюрі 90Sr на 1 г Ca). При пересуванні 90Sr і Ca по біологічних і харчових ланцюгах відбувається дискримінація С., для кількісного вираження якої знаходять «коефіцієнт дискримінації», ставлення 90Sr / Ca в наступному ланці біологічної або харчового ланцюга до цієї ж величиною в попередньому ланці. В кінцевому ланці харчового ланцюга концентрація 90Sr, як правило, значно менше, ніж в початковому.
У рослини 90Sr може надходити безпосередньо при прямому забрудненні листя або з грунту через коріння (при цьому великий вплив має тип ґрунту, се вологість, pH, вміст Ca і органічних речовин і т.д.). Щодо більше накопичують 90Sr бобові рослини, корені-і бульбоплоди, менше - злаки, в тому числі зернові, і льон. У насінні і плодах накопичується значно менше 90Sr, ніж в ін. Органах (наприклад, в листі і стеблах пшениці 90Sr в 10 разів більше, ніж в зерні). У тварин (надходить в основному з рослинною їжею) і людини (надходить в основному з коров'ячим молоком і рибою) 90 Sr накопичується головним чином в кістках. Величина відкладення 90 Sr в організмі тварин і людини залежить від віку особини, кількості що надходить радіонукліда, інтенсивності росту нової кісткової тканини і ін. Велику небезпеку 90Sr представляє для дітей, в організм яких він надходить з молоком і накопичується в швидкому зростанні кісткової тканини.
Біологічна дія 90Sr пов'язано з характером його розподілу в організмі (накопичення в скелеті) і залежить від дози b -опромінення, створюваного ним і його дочірнім радіоізотопом 90Y. При тривалому надходженні 90 Sr в організм навіть у відносно невеликих кількостях, в результаті безперервного опромінення кісткової тканини, можуть розвиватися лейкемія і рак кісток. Істотні зміни в кістковій тканині спостерігаються при вмісті "° Sr в раціоні близько 1 мккюрі на 1 г Ca. Висновок в 1963 в Москві Договору про заборону випробувань ядерної зброї в атмосфері, космосі і під водою привело до майже повного визволення атмосфери від 90Sr і зменшення його рухомих форм в грунті.
В. А. Кальченко.
Літ .: Бурков В. В., Подпоряна Е. К., Стронцій, М., 1962; Булдаков Л. А. і Москальов Ю. І., Проблеми розподілу і експериментальної оцінки допустимих рівнів Cs137, Sr90 і Ru106, М., 1968; Юдінцева Е. В., Гулякіна І. В., Агрохімія радіоактивних ізотопів стронцію і цезію, М., 1968; Метаболізм стронцію. Зб. статей, пров. з англ., М., 1971; Радіоактивність і їжа людини, пер. з англ., М., 1971; Ковальський В. В., Геохімічна екологія, М., 1974; Хеморадіоекологія пелагиали і бенталі, К., 1974; Bowen Н. J. М., Trace elemetns in biochemistry, L. - NY, 1966.